
José Rivera, investigador de la U765 CIBERER que lidera Vicente Vicente en el Hospital Universitario Morales Meseguer de Murcia, ha coordinado un estudio que ha identificado una nueva variante genética responsable de la patología congénita de la enzima ciclooxigenasa-1 (COX-1), un trastorno hematológico caracterizado por un aumento del sangrado.
En el trabajo, publicado en la prestigiosa revista American Journal of Hematology, los autores demuestran que la diátesis hemorrágica y la disfunción plaquetaria en una niña española de ascendencia asiática se debe a que es portadora de una variante genética nueva (c.428A>G [p.Asn143Ser]) en el exón 5 del gen PTGS1 que codifica COX-1. La enzima COX-1 se expresa mayoritariamente en plaquetas y es, junto con tromboxano sintetasa, responsable de la síntesis del tromboxano A2 (TXA2), que es un potente agregante plaquetario.
 |
|
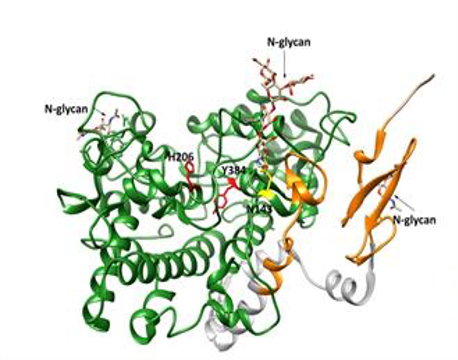
Estructura tridimensional de la enzima COX-1 humana. En amarillo el residuo Asn143, que es uno de los tres aminoácidos N-glicosilados en la enzima. Su mutación a Ser en la enferma previene la N-glicosilación y ocasiona la pérdida de la actividad enzimática. |
La importancia de COX-1 en la hemostasia fisiológica y en la trombosis patológica se refleja muy bien en el hecho de que es la proteína diana de la aspirina, el fármaco más amplia y eficazmente usado en el tratamiento de las enfermedades cardiovasculares.
Lo más novedoso y singular de este estudio es que la mutación missense identificada afecta a uno de los sitios de N-glicosilación de COX-1, dando lugar a una variante de COX-1 hipoglicosilada sin actividad enzimática. Así, los autores demuestran, por primera vez, que la hipoglicosilación de COX-1 es un importante mecanismo de patogenicidad nuevo en este desorden.
Además, mediante estudios en las plaquetas del paciente y en modelos celulares han demostrado que la presencia de la variante genética en heterocigosis ejerce un efecto dominante negativo sobre la actividad enzimática global de COX-1. Ello se explica probablemente por el carácter dimérico de la COX-1 funcional, y una posible ventaja energética de la formación de dímeros entre las isoformas glicosilada (nativa) e hipoglicosilada (mutante) de COX-1.
 |
|
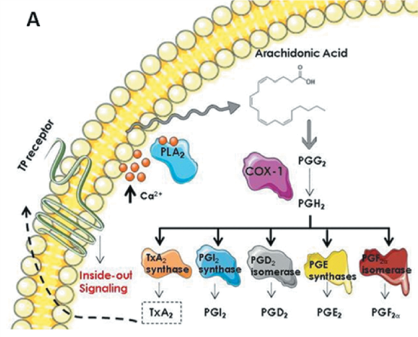
Vía de síntesis plaquetaria de prostanoides. COX-1 es una homodímero bifuncional que cataliza secuencialmente la conversión del ácido araquidónico libre a prostaglandin G2 [PGG2] con su actividad ciclooxigenasa, y después la reducción de PGG2 a prostaglandin H2 [PGH2] con su actividad peroxidasa. A partir de PGH2 se generan los distintos portanoides, incluyendo tromboxane A2 [TXA2] por la acción de la tromboxano sitetasas. |
Este estudio aporta nueva evidencia de la relevancia de los glicanos en la actividad catalítica de las proteínas y, por tanto, en las enfermedades humanas.
En el estudio, han participado también investigadores de la U710 CIBERER en el CIEMAT/IIS-FJD, el Hospital Universitario de Salamanca, el Hospital San Pedro de Alcántara (Cáceres), el Hospital Virgen de la Salud de Toledo y diversas instituciones de Estados Unidos y el Reino Unido.
Artículo de referencia:
“A novel genetic variant in PTGS1 affects N‐glycosylation of cyclooxygenase‐1 causing a dominant‐negative effect on platelet function and bleeding diathesis". Verónica Palma‐Barqueros, Marilena Crescente et al. American Journal of Hematology. DOI: 10.1002/ajh.26076