Investigadores del CIBERER han utilizado métodos de biología estructural para avanzar en la comprensión de PMM2-CDG, el defecto congénito de la glicosilación más frecuente, y apoyar el uso de chaperonas farmacológicas como opción terapéutica para esta enfermedad rara metabólica.
El estudio, publicado en Journal of Inherited Metabolic Disease, ha sido coordinado por Vicente Rubio y Santiago Ramón-Maiques, ambos de la U739 CIBERER en el Instituto de Biomedicina de Valencia (CSIC), y Belén Pérez, de la U746 CIBERER en el Centro de Biología Molecular (UAM-CSIC). Este último grupo trabaja desde hace años en la investigación con chaperonas farmacológicas como posible tratamiento para PMM2-CDG.
Los defectos congénitos de glicosilación (CDG) son un grupo de errores congénitos del metabolismo. El más frecuente, PMM2-CDG, está causado por el déficit de la enzima fosfomanomutasa 2 (PMM2) humana y constituye una enfermedad genética grave para la que hoy por hoy las posibilidades de tratamiento son limitadas.
El nuevo estudio avanza en la propuesta de utilización de las chaperonas farmacológicas, que son moléculas que estabilizan las proteínas y así aumentan su actividad residual, pudiendo disminuir o evitar la deficiencia y los síntomas y manifestaciones de la enfermedad.
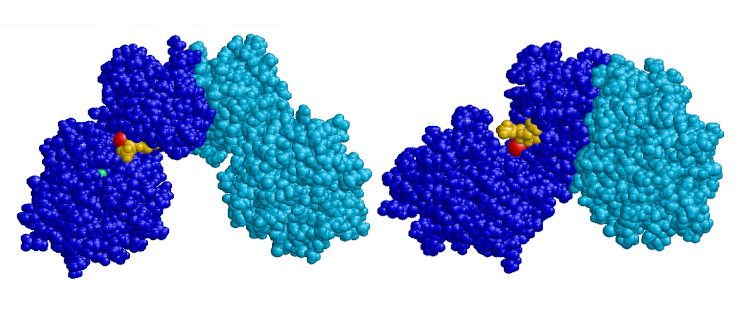
Este trabajo ha recurrido a la biología estructural para tratar de estimar cuantos pacientes podrían beneficiarse de esta terapia. Concretamente, se han centrado en determinar la estructura de la enzima recombinante PMM2 humana, utilizando para ello una tecnología conocida como cristalografía de rayos X. Mediante esta técnica, que ha requerido la utilización de dos grandes instalaciones europeas (sincrotrones ALBA, en Cerdanyola del Vallès, y ESRF, en Grenoble), han podido establecer la estructura completa de la enzima en ausencia de sustratos y en presencia del activador esencial glucosa-1,6-bifosfato. Por primera vez, se ha visualizado la estructura de la enzima entera (un dímero) y se ha establecido la unión a la misma de dos cationes magnesio por subunidad, así como de un anión cloruro en la unión entre las dos subunidades, y se ha caracterizado en parte el movimiento de la molécula proteica asociada a su actividad enzimática.
Sobre esta estructura, obtenida casi a resolución atómica, ha sido posible ubicar cada una de las mutaciones de cambio de sentido encontradas en pacientes con PMM2-CDG. También ha permitido realizar explicaciones plausibles para el mecanismo de producción de la enfermedad por parte de cada mutación, corroboradas para algunas mutaciones en estudios previos de la U746 CIBERER con PMM2 humana. Estos mecanismos de producción de la enfermedad se han tipificado en cinco clases, y han ayudado a fundamentar la necesidad de los dos cationes de magnesio, uno para la catálisis y el otro para la resiliencia estructural de la enzima, y del anión cloruro entre las dos subunidades, que debe reforzar la estabilidad del dímero, forma activa de la enzima.
El estudio concluye que no menos del 50% de las mutaciones de cambio de sentido identificadas en pacientes con PMM2-CDG (alrededor de un centenar que afectan a más de 900 pacientes descritos) sería susceptibles de mejora con chaperonas farmacológicas como la identificada por la U746 CIBERER. Estos resultados, por tanto, apoyan el compromiso con esta opción terapéutica y ayudan a avanzar en el desarrollo de este tipo de terapias para esta y otras enfermedades metabólicas.
Artículo de referencia:
Briso-Montiano A, Del Caño-Ochoa F, Vilas A, Velázquez-Campoy A, Rubio V, Pérez B, Ramón-Maiques S. “Insight on molecular pathogenesis and pharmacochaperoning potential in Phosphomannomutase 2 (PMM2) deficiency, provided by novel human PMM2 structures”. J Inherit Metab Dis. 2021 Dec 3. doi: 10.1002/jimd.12461. Epub ahead of print. PMID: 34859900